电话:027-87686090
地址:湖北省武汉市洪山区珞喻路237号 (430079)
邮箱:esev2022@126.com
急性肾损伤(AKI)是一种常见的疾病,与各种病因有关,其发病率和死亡率都很高。值得注意的是,高达60%的脓毒症患者会发生AKI。然而,脓毒症诱导的AKI(S-AKI)的病理生理学仍不完全清楚。因此,目前的治疗方法是反应性和非特异性的,还没有针对S-AKI的预防性治疗方法。
淋巴结中富含成纤维网状细胞(FRC),其与免疫细胞存在着广泛的正向相互作用,可促进淋巴管的生成和T细胞的存活。最近有研究发现 FRC 移植在小鼠脓毒症中显示出良好的治疗效果,然而FRC 减缓 S-AKI 的确切机制仍不清楚。此外,双膜结合囊泡的外泌体在介导细胞间通讯中发挥着重要作用,探究FRC衍生的Exos(FRC-Exos)在S-AKI中的功能,可为AKI(S-AKI)的治疗与预防研究提供新见解。
为了探究FRC改善S-AKI疾病进程的机制,来自武汉大学中南医院彭志勇教授团队的李一鸣博士等成员开展了深入的研究,在《Kidney International》(IF =19.6)上发表了题为“Fibroblastic reticular cell-derived exosomes are a promising therapeutic approach for septic acute kidney injury”的论文,该研究通过检测FRC衍生的Exos(FRC-Exos)在S-AKI中的功能,揭示了纤维网状细胞外泌体中富含的CD5L通过促进PINK-PARKIN介导的线粒体自噬,可导致NLRP3炎症小体的降解,从而促进肾功能的改善与恢复。

图1 文章发表信息
主要结论
01.FRCs改善脓毒症患者的肾功能并分泌Exos
首先,研究者对小鼠进行盲肠结扎穿孔术(CLP),构建了 S-AKI 模型。在单次腹腔注射FRCs后,CLP手术后血清肌酐(Scr)和血尿素氮(BUN)水平的升高得到显著抑制。为了研究FRCs如何影响肾功能,将荧光标记的FRCs注射到腹膜腔中,对动物进行小动物成像,并对主要器官进行流式细胞术分析。FRCs标记物PDPN的表达表明,注射后24小时和48小时,FRCs主要积聚在腹膜腔中,而很少有FRCs积聚在脾脏或肾脏中。细胞外小泡(EVs)由许多细胞类型释放并在体液中循环,在短距离和长距离细胞间通信中发挥作用,以调节靶细胞的命运。研究者假设FRCs释放的循环EVs介导肾脏修复并有助于减轻肾脏损伤。通过超速离心和过滤方法从FRC培养基中提取Evs,透射电子显微镜图像显示,FRC衍生的纳米颗粒的形态是Exos的典型形态,观察到双凹圆盘状的茶托结构。提取的EVs表达Exo标志物,但不表达非Exo标志物。这些结果表明,用FRCs治疗改善了CLP手术后的肾功能,并且FRCs分泌具有与Exos特征一致的EVs。
接下来,研究者重点关注FRCs的FRC-Exos是否可以提高脓毒症小鼠的存活率。结果发现,CLP后1小时尾状注射体外扩增的FRCs和从FRCs中分离的Exos显著提高了脓毒症小鼠的存活率,治疗24小时后,脓毒症小鼠的肾功能(通过Scr和BUN水平反映)显著改善。此外,我们观察到FRC和FRC-Exos组的乳酸脱氢酶和丙二醛水平显著降低,氧化应激水平降低。以上结果提示,来源于FRCs的Exos能够减轻脓毒症引起的肾损伤。
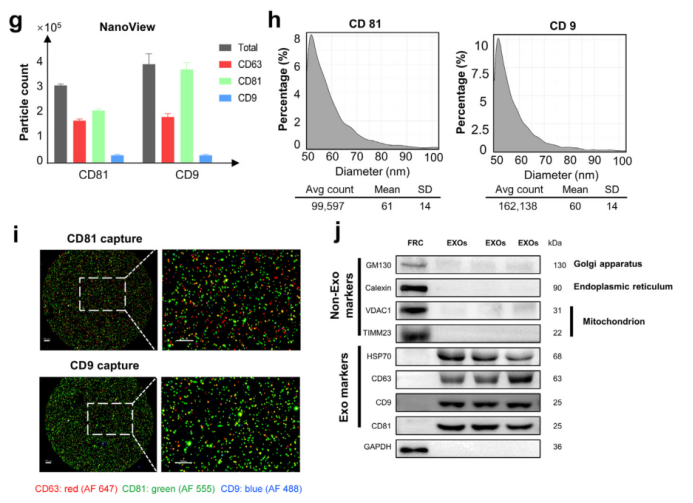
图2 成纤维网状细胞(FRCs)改善肾功能并分泌细胞外小泡(EVs)
02.FRC-Exos 减缓肾损伤的分子机制
荧光标记实验证明来源于FRCs的FRC-Exos可以聚集到受伤的肾脏。因此,体内和体外实验证实,FRC衍生的Exos回到受伤的肾脏,并被肾小管细胞吸收。随后,研究者对FRC-Exos 减缓肾损伤的分子机制进行了深入探讨。
首先,研究者对脂多糖(LPS)刺激后(有或没有FRC-Exos处理)培养的PKTC进行转录组分析。差异表达基因的GO分析显示,免疫系统、信号转导和代谢是受LPS处理影响的前三大途径。此外,研究者将FRC-Exos添加到用LPS刺激的PKTC的培养基中,并进行GO分析以确定FRC-Exo在肾脏中的生物学功能,聚焦在线粒体自噬、细胞焦亡和细胞凋亡。在LPS刺激后,线粒体被碎片化并表现出嵴消失。FRC-Exos治疗在很大程度上逆转了这种影响。LPS处理24小时后,在整个细胞表面上分布了许多不同大小的孔,并且使用扫描电子显微镜(SEM)观察到了细胞焦亡的典型特征,包括细胞肿胀和细胞膜表面的焦亡小泡。FRC-Exos显著减少PKTC细胞焦亡。这些结果表明,FRC-Exos通过调节S-AKI中的线粒体自噬和细胞焦亡来影响PKTCs的命运。
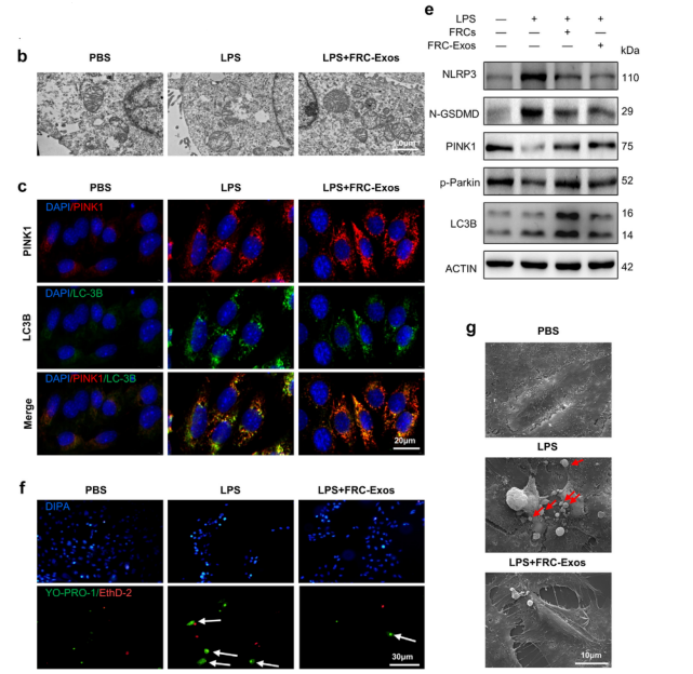
图3 FRC-Exos在肾小管上皮细胞命运中的作用
其次,研究者进行体内实验验证。在 CLP 术后立即尾静脉注射 FRC-Exos,结果发现实验组中,肾小管细胞中的自噬体数量显著增加,且线粒体的自噬标志物LC3-II 、以及其他自噬相关的蛋白水平均上调。在肾小管细胞中,用FCCP处理后,TOMM20 和 TIMM23 的表达显著降低,FRC-Exos 治疗也有类似效果,这说明FRC-Exos可促进PINK1 依赖性线粒体的自噬。相反的,在肾小管细胞中,用Mdivi-1处理后,发现NLRP3 炎性体形成,这说明FRC-Exos 可通过促进 S-AKI 中的线粒体自噬来阻止 NLRP3 炎性体的激活。

图4 FRC-Exos限制NLRP3炎症小体的激活
03.FRC-Exos通过CD5L改善脓毒症引起的肾损伤
为了进一步阐明FRC Exos保护作用的机制,研究者使用了经典活化的巨噬细胞衍生的Exos(M1 Exos)作为对照。研究者发现,与M1 Exos相反,FRC-Exo激活了PINK-Parkin通路,并减少了NLRP3炎症小体的形成。质谱法用于鉴定M1 Exos和FRC-Exo中的蛋白质,研究者发现了一系列在FRC Exos中高度富集的蛋白质,其中CD5L表现出最大的表达差异。此外,研究者发现肾功能改善的脓毒症AKI患者CD5L水平升高,而肾功能恶化的脓毒病AKI患者的CD5L含量降低。通过SEM观察到,在FRC-Exos和rCD5L处理后,PKTC的细胞焦亡也明显减轻,并且这种升高伴随着ROS水平的降低。LPS刺激后,GSDMD与PKTC中的线粒体共定位,在FRC-Exos或rCD5L处理后,这种作用显著降低。这些结果表明,FRC Exos通过CD5L促进线粒体自噬和抑制细胞焦亡来减轻脓毒性肾损伤。
最后,通过小鼠实验,研究者证实了改良的CD5L-FRC-Exos可特异性靶向脓毒症的肾脏组织,将 CD5L 转运到受损的肾小管细胞,以促进线粒体自噬,改善肾功能,最终降低死亡率。
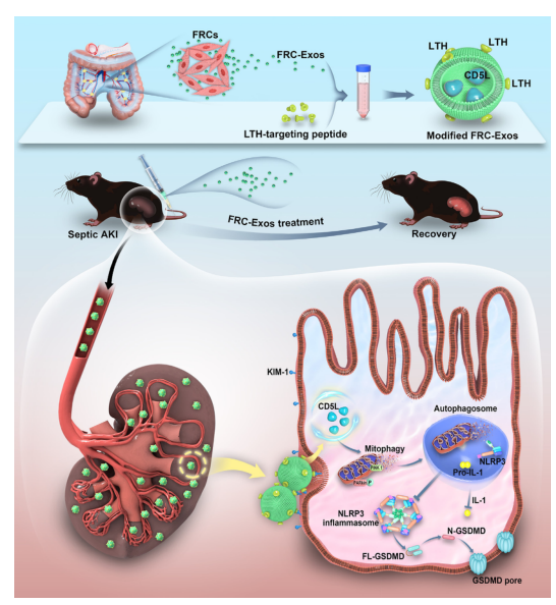
图5 改良的FRCExos减轻脓毒症诱导的急性肾损伤(S-AKI)的潜在机制
结论
本研究中,研究者结合体内、体外、多组学实验,提供了令人信服的证据,证明FRCs分泌的Exos改善S-AKI,CD5L是FRC-Exos中含量最丰富的蛋白质。修饰的富含CD5L的FRC-Exos选择性结合肾小管细胞,通过促进PINK-Parkin介导的线粒体自噬抑制NLRP3炎症小体激活,从而改善肾功能和存活率。研究结果表明,FRC-Exos是一种很有前途的药物递送载体,对S-AKI具有巨大的靶向治疗潜力。
-------------------------------------------------------------

湖北省细胞外囊泡学会常务理事,武汉大学中南医院重症医学科主任,教授/主任医师,博士生导师
对重症患者急性肾损伤、脓毒症器官功能损伤和血液净化治疗有深入的研究和丰富的临床经验。长期致力于脓毒症急性肾损伤及血液净化等领域的研究,近五年来先后主持国家自然科学基金项目5项 (共计275万元);主持科技部重大专项 1 项(获 1466 万元资助)。申请者以第一作者或以通讯作者的身份,在医学领域顶级刊物 JAMA、Critical Care、Critical CareMedicine发表多篇论文,SCI论文89余篇,引用次数高达 20000 余次,总影响因子超过 500。担任国际专业期刊 Shock(美国)、Journal of Critical Care(美国)和 Blood Purification(欧洲)杂志的编委。另外,作为国际组织《急性疾病质量改进组织,ADQI》及《改善全球肾脏病预后组织,KDIGO》的重要成员,多次参与临床指南/共识的修订工作,有关的文章发表在 Nature Review 等杂志上。多次应邀嘉参加美国重症医学会(SCCM)、欧洲重症医学会(ESICM)年会并作大会报告,并任美国重症医学会科学评审委员会委、欧洲重症学会急性肾损伤专业委员会委员。